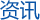根据实验测知:在水的分子中,两个氢原子与一个氧原子并不在同一条直线上,而是形成以氧核为顶角的等腰三角形。在气态水分子中,等腰三角形的顶角等于104.5。而O—H距离等于0.09568纳米,H—H距离等于0.154纳米。理论上,水分子的等腰三角形结构可作如下解释;氢原子的电子层结构为(1s)1,有一个未配对的电子,而氧原子的外电子层结构为(2s)2(2px)2(2py)1(2pz)1,有两个未配对的电子。根据电子配对理论,氧原子由于只能提供两个未配对的电子和两个p轨道(即2py,和2pz),所以只能与两个氢原子(每个氢原子只能提供一个s电子和一个s轨道)结合而形成两个♀键。氧原子和氢原子成键变为水分子的情况如图1-1所示。由图可见,氧原子的2py和2pz轨道是互相垂直的,它们各自与氢原子的1s轨道重迭形成的两个♀键的键角应为90°。然而,实际上键角比此值略大,这是由于两对价电子相互排斥的结果。H2O的价键结构式可表示为
 ,其中氧原子除了提供两个未配对的电子与两个氢原子形成两个单键外,在其外电子层还有两双孤对电子。
,其中氧原子除了提供两个未配对的电子与两个氢原子形成两个单键外,在其外电子层还有两双孤对电子。在水的分子中,由于氧的电负性远大于氢,所以价电子对强烈地偏于氧核,而使两个氢核几乎“裸露”出来。这样,便使水分子成为一端带正电、而另一端带负电的典型极性分子。水之所以极易溶解离子型化合物,与其极性密切相关。
另外,每个水分子的氢核,都可以吸引其它水分子中的孤对电子,而同一水分子的孤对电子,又能同时吸引其它水分子的氢核。这种氢核与孤对电子间的静电吸引作用,就是形成氢键的根源。由于水分子中的键角是确定的,所以氢键具有方向性。氢键可使许许多多的水分子相互联接起来,构成空间立体结构。图1—2是水分子间形成氢键的示意图。

水分子除了本身能形成氢键外,还可与其它的分子形成氢键,这就是一些分子型的极性物质能溶于水的原因。